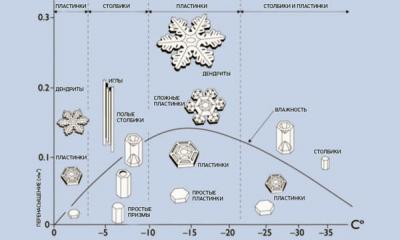
Cl 2 при об. Т - газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха - в 2,5 раза, малорастворим в воде (~ 6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Способы получения
Основаны на процессе окисления анионов Cl -
2Cl - - 2e - = Cl 2 0
Промышленный
Электролиз водных растворов хлоридов, чаще - NaCl:
2NaCl + 2Н 2 O = Cl 2 + 2NaOH + H 2
Лабораторные
Окисление конц. HCI различными окислителями:
4HCI + MnO 2 = Cl 2 + МпCl 2 + 2Н 2 O
16НСl + 2КМпО 4 = 5Cl 2 + 2MnCl 2 + 2KCl + 8Н 2 O
6HCl + КСlO 3 = ЗCl 2 + KCl + 3Н 2 O
14HCl + К 2 Сr 2 O 7 = 3Cl 2 + 2CrCl 3 + 2KCl + 7Н 2 O
Химические свойства
Хлор - очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl - :
Cl 2 0 + 2e - = 2Cl -
Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Cl 2 + 2Na = 2NaCl
3Cl 2 + 2Fe = 2FeCl 3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Cl 2 + Сu = CuCl 2
3Cl 2 + 2Аu = 2AuCl 3
Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O 2 , N 2 , С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Cl 2 + Н 2 =2НС1
Cl 2 + 2S (расплав) = S 2 Cl 2
ЗCl 2 + 2Р = 2РCl 3 (или РCl 5 - в избытке Cl 2)
2Cl 2 + Si = SiCl 4
3Cl 2 + I 2 = 2ICl 3
Вытеснение свободных неметаллов (Вr 2 , I 2 , N 2 , S) из их соединений
Cl 2 + 2KBr = Br 2 + 2KCl
Cl 2 + 2KI = I 2 + 2KCl
Cl 2 + 2HI = I 2 + 2HCl
Cl 2 + H 2 S = S + 2HCl
ЗСl 2 + 2NH 3 = N 2 + 6HCl
Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl - , а другие в положительной степени окисления входят в состав анионов ClO - или ClO 3 - .
Cl 2 + Н 2 O = HCl + НClO хлорноватистая к-та
Cl 2 + 2КОН =KCl + KClO + Н 2 O
3Cl 2 + 6КОН = 5KCl + KClO 3 + 3Н 2 O
3Cl 2 + 2Са(ОН) 2 = CaCl 2 + Са(ClO) 2 + 2Н 2 O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO 3 и Са(ClO) 2 - гипохлориты; КClO 3 - хлорат калия (бертолетова соль).
Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl 2 по месту разрыва кратных углерод-углеродных связей
H 2 C=CH 2 + Cl 2 → ClH 2 C-CH 2 Cl 1,2-дихлорэтан
HC≡CH + 2Cl 2 → Cl 2 HC-CHCl 2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
Газообразный хлороводород
Физические и химические свойства
HCl - хлорид водорода. При об. Т - бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F 2 = Сl 2 + 2HF
4HCl + O 2 = 2Сl 2 + 2Н 2 O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Способы получения
1. Синтез из простых веществ:
Н 2 + Cl 2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl 2 = R-Cl + HCl
3. В лаборатории получают действием конц. H 2 SO 4 на хлориды:
H 2 SО 4 (конц.) + NaCl = 2HCl + NaHSО 4 (при слабом нагревании)
H 2 SО 4 (конц.) + 2NaCl = 2HCl + Na 2 SО 4 (при очень сильном нагревании)
Водный раствор HCl - сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н 2 O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
HCl → H + + Cl -
Взаимодействие:
а) с металлами (до Н):
2HCl 2 + Zn = ZnCl 2 + H 2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl 2 + Н 2 O
6HCl + Аl 2 O 3 = 2АlCl 3 + ЗН 2 O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН) 2 = CaCl 2 + 2Н 2 О
3HCl + Аl(ОН) 3 = АlСl 3 + ЗН 2 O
г) с солями более слабых кислот:
2HCl + СаСО 3 = CaCl 2 + СO 2 + Н 3 O
HCl + C 6 H 5 ONa = С 6 Н 5 ОН + NaCl
д) с аммиаком:
HCl + NH 3 = NH 4 Cl
Реакции с сильными окислителями F 2 , MnO 2 , KMnO 4, KClO 3, K 2 Cr 2 O 7 . Анион Cl - окисляется до свободного галогена:
2Cl - - 2e - = Cl 2 0
Уравнения реакция см. "Получение хлора". Особое значение имеет ОВР между соляной и азотной кислотами:

Реакции с органическими соединениями
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH 2 + HCl → + Cl -
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислотные оксиды

Кислоты

Соли
Химические свойства
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.

Хлорная известь
Хлорная (белильная) известь - смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H 2 O
Хлор
ХЛОР -а; м. [от греч. chlōros - бледно-зелёный] Химический элемент (Cl), удушливый газ зеленовато-жёлтого цвета с резким запахом (используется как отравляющее и обеззараживающее средство). Соединения хлора. Отравление хлором.
◁ Хло́рный (см.).
хлор(лат. Chlorum), химический элемент VII группы периодической системы, относится к галогенам. Название от греческого chlōros - жёлто-зелёный. Свободный хлор состоит из двухатомных молекул (Cl 2); газ жёлто-зелёного цвета с резким запахом; плотность 3,214 г/л; t пл -101°C; t кип -33,97°C; при обычной температуре легко сжижается под давлением 0,6 МПа. Химически очень активен (окислитель). Главные минералы - галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и других элементов. Применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбеливания целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды. Токсичен.
ХЛОРХЛОР (лат. Сhlorum), Cl (читается «хлор»), химический элемент с атомным номером 17, атомная масса 35,453. В свободном виде - желто-зеленый тяжелый газ с резким удушливым запахом (отсюда название: греч. chloros - желто-зеленый).
Природный хлор представляет смесь двух нуклидов (см.
НУКЛИД)
с массовыми числами 35 (в смеси 75,77% по массе) и 37 (24,23%). Конфигурация внешнего электронного слоя 3s
2
p
5
. В соединениях проявляет главным образом степени окисления –1, +1, +3, +5 и +7 (валентности I, III, V и VII).
Расположен в третьем периоде в группе VIIА периодической системы элементов Менделеева, относится к галогенам (см.
ГАЛОГЕНЫ)
.
Радиус нейтрального атома хлора 0,099 нм, ионные радиусы равны, соответственно (в скобках указаны значения координационного числа): Cl - 0,167 нм (6), Cl 5+ 0,026 нм (3) и Clr 7+ 0,022 нм (3) и 0,041 нм (6). Энергии последовательной ионизации нейтрального атома хлора равны, соответственно, 12,97, 23,80, 35,9, 53,5, 67,8, 96,7 и 114,3 эВ. Сродство к электрону 3,614 эВ. По шкале Полинга электроотрицательность хлора 3,16.
История открытия
Важнейшее химическое соединение хлора - поваренная соль (химическая формула NaCl, химическое название хлорид натрия) - было известно человеку с древнейших времен. Имеются свидетельства того, что добыча поваренной соли осуществлялась еще 3-4 тысячи лет до нашей эры в Ливии. Возможно, что, используя поваренную соль для различных манипуляций, алхимики сталкивались и с газообразным хлором. Для растворения «царя металлов» - золота - они использовали «царскую водку» - смесь соляной и азотной кислот, при взаимодействии которых выделяется хлор.
Впервые газ хлор получил и подробно описал шведский химик К. Шееле (см.
ШЕЕЛЕ Карл Вильгельм)
в 1774 году. Он нагревал соляную кислоту с минералом пиролюзитом (см.
ПИРОЛЮЗИТ)
MnO 2 и наблюдал выделение желто-зеленого газа с резким запахом. Так как в те времена господствовала теория флогистона (см.
ФЛОГИСТОН)
, новый газ Шееле рассматривал как «дефлогистонированную соляную кислоту», т. е. как окись (оксид) соляной кислоты. А.Лавуазье (см.
ЛАВУАЗЬЕ Антуан Лоран)
рассматривал газ как оксид элемента «мурия» (соляную кислоту называли муриевой, от лат. muria - рассол). Такую же точку зрения сначала разделял английский ученый Г. Дэви (см.
ДЭВИ Гемфри)
, который потратил много времени на то, чтобы разложить «окись мурия» на простые вещества. Это ему не удалось, и к 1811 году Дэви пришел к выводу, что данный газ - это простое вещество, и ему отвечает химический элемент. Дэви первым предложил в соответствие с желто-зеленой окраской газа назвать его chlorine (хлорин). Название «хлор» элементу дал в 1812 французский химик Ж. Л. Гей-Люссак (см.
ГЕЙ-ЛЮССАК Жозеф Луи)
; оно принято во всех странах, кроме Великобритании и США, где сохранилось название, введенное Дэви. Высказывалось мнение о том, что данный элемент следует назвать «галоген» (т. е. рождающий соли), но оно со временем стало общим названием всех элементов группы VIIA.
Нахождение в природе
Содержание хлора в земной коре составляет 0,013% по массе, в заметной концентрации он в виде иона Cl – присутствует в морской воде (в среднем около 18,8 г/л). Химически хлор высоко активен и поэтому в свободном виде в природе не встречается. Он входит в состав таких минералов, образующих большие залежи, как поваренная, или каменная, соль (галит (см.
ГАЛИТ)
) NaCl, карналлит (см.
КАРНАЛЛИТ)
KCl·MgCl 2 ·6H 21 O, сильвин (см.
СИЛЬВИН)
КСl, сильвинит (Na, K)Cl, каинит (см.
КАИНИТ)
КСl·MgSO 4 ·3Н 2 О, бишофит (см.
БИШОФИТ)
MgCl 2 ·6H 2 O и многих других. Хлор можно обнаружить в самых разных породах, в почве.
Получение
Для получения газообразного хлора используют электролиз крепкого водного раствора NaCl (иногда используют KCl). Электролиз проводят с использованием катионообменной мембраны, разделяющей катодное и анодное пространства. При этом за счет процесса
2NaCl + 2H 2 O = 2NaOH + H 2 + Cl 2
получают сразу три ценных химических продукта: на аноде - хлор, на катоде - водород (см.
ВОДОРОД)
, и в электролизере накапливается щелочь (1,13 тонны NaOH на каждую тонну полученного хлора). Производство хлора электролизом требует больших затрат электроэнергии: на получение1 т хлора расходуется от 2,3 до 3,7 МВт.
Для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с каким-либо сильным окислителем (перманганатом калия KMnO 4 , дихроматом калия K 2 Cr 2 O 7 , хлоратом калия KClO 3 , хлорной известью CaClOCl, оксидом марганца (IV) MnO 2). Наиболее удобно использовать для этих целей перманганат калия: в этом случае реакция протекает без нагревания:
2KMnO 4 + 16HCl = 2KСl + 2MnCl 2 + 5Cl 2 + 8H 2 O.
При необходимости хлор в сжиженном (под давлением) виде транспортируют в железнодорожных цистернах или в стальных баллонах. Баллоны с хлором имеют специальную маркировку, но даже при ее отсутствии хлорный баллон легко отличить от баллонов с другими неядовитыми газами. Дно хлорных баллонов имеет форму полушария, и баллон с жидким хлором невозможно без опоры поставить вертикально.
Физические и химические свойства
При обычных условиях хлор - желто-зеленый газ, плотность газа при 25°C 3,214 г/дм 3 (примерно в 2,5 раза больше плотности воздуха). Температура плавления твердого хлора –100,98°C, температура кипения –33,97°C. Стандартный электродный потенциал Сl 2 /Сl - в водном растворе равен +1,3583 В.
В свободном состоянии существует в виде двухатомных молекул Сl 2 . Межъядерное расстояние в этой молекуле 0,1987 нм. Сродство к электрону молекулы Сl 2 2,45 эВ, потенциал ионизации 11,48 эВ. Энергия диссоциации молекул Сl 2 на атомы сравнительно невелика и составляет 239,23 кДж/моль.
Хлор немного растворим в воде. При температуре 0°C растворимость составляет 1,44 масс.%, при 20°C - 0,711°C масс.%, при 60°C - 0,323 масс. %. Раствор хлора в воде называют хлорной водой. В хлорной воде устанавливается равновесие:
Сl 2 + H 2 O H + = Сl - + HOСl.
Для того, чтобы сместить это равновесие влево, т. е. понизить растворимость хлора в воде, в воду следует добавить или хлорид натрия NaCl, или какую-либо нелетучую сильную кислоту (например, серную).
Хлор хорошо растворим во многих неполярных жидкостях. Жидкий хлор сам служит растворителем таких веществ, как ВСl 3 , SiCl 4 , TiCl 4 .
Из-за низкой энергии диссоциации молекул Сl 2 на атомы и высокого сродства атома хлора к электрону химически хлор высоко активен. Он вступает в непосредственное взаимодействие с большинством металлов (в том числе, например, с золотом) и многими неметаллами. Так, без нагревания хлор реагирует с щелочными (см.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ)
и щелочноземельными металлами (см.
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ)
, с сурьмой:
2Sb + 3Cl 2 = 2SbCl 3
При нагревании хлор реагирует с алюминием:
3Сl 2 + 2Аl = 2А1Сl 3
и железом:
2Fe + 3Cl 2 = 2FeCl 3 .
С водородом H 2 хлор реагирует или при поджигании (хлор спокойно горит в атмосфере водорода), или при облучении смеси хлора и водорода ультрафиолетовым светом. При этом возникает газ хлороводород НСl:
Н 2 + Сl 2 = 2НСl.
Раствор хлороводорода в воде называют соляной (см.
СОЛЯНАЯ КИСЛОТА)
(хлороводородной) кислотой. Максимальная массовая концентрация соляной кислоты около 38%. Соли соляной кислоты - хлориды (см.
ХЛОРИДЫ)
, например, хлорид аммония NH 4 Cl, хлорид кальция СаСl 2 , хлорид бария ВаСl 2 и другие. Многие хлориды хорошо растворимы в воде. Практически нерастворим в воде и в кислых водных растворах хлорид серебра AgCl. Качественная реакция на присутствие хлорид-ионов в растворе - образование с ионами Ag + белого осадка AgСl, практически нерастворимого в азотнокислой среде:
СаСl 2 + 2AgNO 3 = Ca(NO 3) 2 + 2AgCl.
При комнатной температуре хлор реагирует с серой (образуется так называемая однохлористая сера S 2 Cl 2) и фтором (образуются соединения ClF и СlF 3). При нагревании хлор взаимодействует с фосфором (образуются, в зависимости от условий проведения реакции, соединения РСl 3 или РСl 5), мышьяком, бором и другими неметаллами. Непосредственно хлор не реагирует с кислородом, азотом, углеродом (многочисленные соединения хлора с этими элементами получают косвенными путями) и инертными газами (в последнее время ученые нашли способы активирования подобных реакций и их осуществления «напрямую»). С другими галогенами хлор образует межгалогенные соединения, например, очень сильные окислители - фториды ClF, ClF 3 , ClF 5 . Окислительная способность хлора выше, чем брома, поэтому хлор вытесняет бромид-ион из растворов бромидов, например:
Cl 2 + 2NaBr = Br 2 + 2NaCl
Хлор вступает в реакции замещения со многими органическими соединениями, например, с метаном СН 4 и бензолом С 6 Н 6:
СН 4 + Сl 2 = СН 3 Сl + НСl или С 6 Н 6 + Сl 2 = С 6 Н 5 Сl + НСl.
Молекула хлора способна присоединятся по кратным связям (двойным и тройным) к органическим соединениям, например, к этилену С 2 Н 4:
С 2 Н 4 + Сl 2 = СН 2 СlСН 2 Сl.
Хлор вступает во взаимодействие с водными растворами щелочей. Если реакция протекает при комнатной температуре, то образуются хлорид (например, хлорид калия КCl) и гипохлорит (см.
ГИПОХЛОРИТЫ)
(например, гипохлорит калия КClО):
Cl 2 + 2КОН = КClО + КСl +Н 2 О.
При взаимодействии хлора с горячим (температура около 70-80°C) раствором щелочи образуется соответствующий хлорид и хлорат (см.
ХЛОРАТЫ)
, например:
3Сl 2 + 6КОН= 5КСl + КСlО 3 + 3Н 2 О.
При взаимодействии хлора с влажной кашицей из гидроксида кальция Са(ОН) 2 образуется хлорная известь (см.
ХЛОРНАЯ ИЗВЕСТЬ)
(«хлорка») СаСlОСl.
Степени окисления хлора +1 отвечает слабая малоустойчивая хлорноватистая кислота (см.
ХЛОРНОВАТИСТАЯ КИСЛОТА)
НСlО. Ее соли - гипохлориты, например, NaClO - гипохлорит натрия. Гипохлориты - сильнейшие окислители, широко используются как отбеливающие и дезинфицирующие агенты. При взаимодействии гипохлоритов, в частности, хлорной извести, с углекислым газом СО 2 образуется среди других продуктов летучая хлорноватистая кислота (см.
ХЛОРНОВАТИСТАЯ КИСЛОТА)
, которая может разлагаться с выделением оксида хлора (I) Сl 2 О:
2НСlО = Сl 2 О + Н 2 О.
Именно запах этого газа Сl 2 О - характерный запах «хлорки».
Степени окисления хлора +3 отвечает малоустойчивая кислота средней силы НСlО 2 . Эту кислоту называют хлористой, ее соли - хлориты (см.
ХЛОРИТЫ (соли))
, например, NaClO 2 - хлорит натрия.
Степени окисления хлора +4 соответствует только одно соединение - диоксид хлора СlО 2 .
Степени окисления хлора +5 отвечает сильная, устойчивая только в водных растворах при концентрации ниже 40%, хлорноватая кислота (см.
ХЛОРНОВАТИСТАЯ КИСЛОТА)
НСlО 3 . Ее соли - хлораты, например, хлорат калия КСlО 3 .
Степени окисления хлора +6 соответствует только одно соединение - триоксид хлора СlО 3 (существует в виде димера Сl 2 О 6).
Степени окисления хлора +7 отвечает очень сильная и довольно устойчивая хлорная кислота (см.
ХЛОРНАЯ КИСЛОТА)
НСlО 4 . Ее соли - перхлораты (см.
ПЕРХЛОРАТЫ)
, например, перхлорат аммония NH 4 ClO 4 или перхлорат калия КСlО 4 . Следует отметить, что перхлораты тяжелых щелочных металлов - калия, и особенно рубидия и цезия мало растворимы в воде. Оксид, соответствующий степени окисления хлора +7 - Сl 2 О 7 .
Среди соединений, содержащих хлор в положительных степенях окисления, наиболее сильными окислительными свойствами обладают гипохлориты. Для перхлоратов окислительные свойства нехарактерны.
Применение
Хлор - один из важнейших продуктов химической промышленности. Его мировое производство составляет десятки миллионов тонн в год. Хлор используют для получения дезинфицирующих и отбеливающих средств (гипохлорита натрия, хлорной извести и других), соляной кислоты, хлоридов многих металлов и неметаллов, многих пластмасс (поливинилхлорида (см.
ПОЛИВИНИЛХЛОРИД)
и других), хлорсодержащих растворителей (дихлорэтана СН 2 СlСН 2 Сl, четыреххлористого углерода ССl 4 и др.), для вскрытия руд, разделения и очистки металлов и т.д. Хлор применяют для обеззараживания воды (хлорирования (см.
ХЛОРИРОВАНИЕ)
) и для многих других целей.
Биологическая роль
Хлор относится к важнейшим биогенным элементам (см.
БИОГЕННЫЕ ЭЛЕМЕНТЫ)
и входит в состав всех живых организмов. Некоторые растения, так называемые галофиты, не только способны расти на сильно засоленных почвах, но и накапливают в больших количествах хлориды. Известны микроорганизмы (галобактерии и др.) и животные, обитающие в условиях высокой солености среды. Хлор - один из основных элементов водно-солевого обмена животных и человека, определяющих физико-химические процессы в тканях организма. Он участвует в поддержании кислотно-щелочного равновесия в тканях, осморегуляции (см.
ОСМОРЕГУЛЯЦИЯ)
(хлор - основное осмотически активное вещество крови, лимфы и др. жидкостей тела), находясь, в основном, вне клеток. У растений хлор принимает участие в окислительных реакциях и фотосинтезе.
Мышечная ткань человека содержит 0,20-0,52% хлора, костная - 0,09%; в крови - 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Особенности работы с хлором
Хлор - ядовитый удушливый газ, при попадании в легкие вызывает ожог легочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л. Хлор был одним из первых химических отравляющих веществ (см.
ОТРАВЛЯЮЩИЕ ВЕЩЕСТВА)
, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na 2 SO 3 или тиосульфата натрия Na 2 S 2 O 3 . ПДК хлора в воздухе рабочих помещений 1 мг/м 3 , в воздухе населенных пунктов 0,03 мг/м 3 .
Основным промышленным методом получения является концентрированного NaCl (рис. 96). При этом на выделяется (2Сl’ – 2e– = Сl 2), а в катодном пространстве выделяется (2Н · + 2e – = H 2) и образует NaOH.
При лабораторном получении обычно пользуются действием МnО 2 или КМnО 4 на :
МnО 2 + 4НСl = МnСl 2 + Cl 2 + 2Н 2 О
2КМnО 4 + 16НСl = 2КСl + 2МnСl 2 + 5Сl 2 + 8Н 2 О
По своей характерной химической функции подобен - он также является активным одновалентным металлоидом. Однако его меньше, чем у . Поэтому последний способен вытеснять из соединений.
Взаимодействие с по Н 2 + Cl 2
= 2HCl + 44 ккал
при обычных условиях протекает крайне медленно, но при нагревании смеси или ее сильном освещении (прямым солнечным светом, горящим и т. д.) сопровождается .
NaCl + H 2 SO 4 = NaHSO 4 + HCl
NaCl + NaHSO 4 = Na 2 SO 4 + HCl
Первая из них отчасти протекает уже при обычных условиях и практически нацело – при слабом нагревании; вторая осуществляется лишь при более высоких . Для проведения процесса служат механические большой производительности.
Сl 2 + Н 2 О = НСl + НОСl
Будучи соединением неустойчивым, НОСl медленно разлагается даже в таком разбавленном . называются хлорноватистокислыми, или . Сама НОСl и ее являются очень сильными .
Добиться этого проще всего добавлением к реакционной смеси . Так как по мере образования Н будут связываться ОН" в недиссоциированные , сместится вправо. Применяя, например, NaOH имеем:
Сl 2 + Н 2 О <–––> НОСl + НСl
HOCl + НСl + 2NaOH –––>NaOCl + NaCl + 2H 2 O
или в общем:
Сl 2 + 2NaOH –––>NaOCl + NaCl + Н 2 О
В результате взаимодействия с получается, следовательно, смесь хлорноватистой и . Образующийся (« ») обладает сильными окислительными свойствами и широко применяется для отбелки и .
1) НОСl = НСl + О
2) 2НОСl = Н 2 О + Сl 2 О
3) 3HOCl = 2НСl + НСlО 3
Все эти процессы способны протекать одновременно, но их относительные скорости сильно зависят от имеющихся условий. Изменяя последние, можно добиться того, что превращение пойдет практически нацело по какому–нибудь одному направлению.
Под действием прямого солнечного света разложение идет по первому из них. Так же протекает оно в присутствии , способных легко присоединять , и некоторых (например» ).
Распад НОСl по третьему типу особенно легко идет при нагревании. Поэтому действие на горячий выражается суммарным уравнением:
ЗСl 2 + 6КОН = KClO 3 + 5КСl + 3Н 2 О
2КСlO 3 + Н 2 С 2 O 4 = K 2 CO 3 + CO 2 + H 2 O + 2ClO 2
образуется зеленовато–желтая двуокись (г. пл. – 59 °С, т. кип. + 10 °С). Свободная ClO 2 малоустойчива и способна разлагаться со
Хлор, можно сказать, уже постоянный спутник нашей повседневной жизни. Редко в каком доме не будет бытовых средств, основанных на обеззараживающем действии данного элемента. Но вместе с тем он очень опасен для человека! Хлор может проникнуть в организм через слизистую оболочку дыхательной системы, пищеварительных путей, кожные покровы. Отравиться им можно и дома, и на отдыхе - во многих бассейнах, аквапарках он является основным средством водоочистки. Влияние хлора на организм человека резко негативное, он может стать причиной серьезных дисфункций и даже смерти. Поэтому каждому нужно быть в курсе симптоматики отравления, методов оказания первой помощи.
Хлор - что это за вещество
Хлор - газообразный элемент желтоватого цвета. Обладает резким специфичным запахом - В газообразном виде, а также в химических формах, что подразумевают его активное состояние, опасен, токсичен для человека.
Хлор в 2,5 раз тяжелее воздуха, поэтому при утечке будет стелиться по оврагам, пространствам первых этажей, по полу помещения. При вдыхании его у пострадавшего может развиться одна из форм отравления. Об этом поговорим далее.
Симптомы отравления
Как длительное вдыхание паров, так и иное воздействие вещества очень опасно. Так как оно активно, то влияние хлора на организм человека проявляется быстро. Токсичный элемент в большей степени поражает глаза, слизистые и кожные покровы.
Отравление может быть как острым, так и хроническим. Однако в любом случае при несвоевременном оказании помощи грозит летальный исход!
Симптоматика при отравлении парами хлора может быть разной - в зависимости от специфики случая, длительности воздействия и прочих факторов. Для удобства мы разграничили признаки в таблице.
| Степень отравления | Симптоматика |
| Легкая. Самая безопасная - проходит самостоятельно, в среднем, за три дня. | Раздражение, покраснение слизистых оболочек, кожных покровов. |
| Средняя. Требуется медицинская помощь и комплексное лечение! | Нарушение сердечного ритма, удушье, боли в области грудной клетки, нехватка воздуха, обильное слезотечение, сухой кашель, чувство жжения на слизистых оболочках. Самый опасный симптом-последствие - отек легких. |
| Тяжелая. Нужны реанимационные меры - летальный исход может наступить через 5-30 минут! | Головокружение, жажда, судороги, потеря сознания. |
| Молниеносная. К сожалению, в большинстве случаев помощь бывает бесполезна - смерть наступает практически мгновенно | Судороги, вздутие вен на лице и на шее, нарушение дыхания, остановка биения сердца. |
| Хроническая. Следствие частой работы с веществом, которое содержит хлор. | Кашель, судороги, хронические заболевания дыхательной системы, частые головные боли, депрессия, апатия, нередки случаи потери сознания. |
Таково влияние хлора на организм человека. Поговорим о том, где можно отравиться его ядовитыми парами и как оказать первую помощь в этом случае.
Отравление на работе
Газ хлор применяют во многих отраслях промышленности. Вы вполне можете получить хроническую форму отравления, если работаете на следующих производствах:
- Химическая промышленность.
- Текстильная фабрика.
- Фармацевтическая индустрия.
Отравление на отдыхе

Хотя многие и знают о влиянии хлора на организм человека (разумеется, в больших объемах), не во всех саунах, бассейнах, развлекательных водных комплексах строго следят за использованием такого бюджетного обеззараживающего средства. А ведь его дозировку очень легко случайно превысить. Отсюда хлорное отравление посетителей, которое случается в наше время достаточно часто.
Как заметить, что в ваш визит доза элемента в воде бассейна превышена? Очень просто - вы почувствуете сильный специфический запах вещества.
Что случится, если вы часто посещаете бассейн, где нарушают инструкцию по применению «Дез-хлора»? Посетителей должна насторожить постоянная сухость кожи, ломкость ногтей и волос. Кроме того, искупавшись в сильно хлорированной воде, вы рискуете получить легкое отравление элементом. Оно проявляет себя следующими симптомами:
- кашель;
- рвота;
- тошнота;
- в редких случаях возникает воспаление легких.
Отравление дома

Отравление может грозить вам и дома, в случае, если вы нарушили инструкцию по применению «Дез-хлора». Также часто встречается хроническая форма отравления. Она развивается, если домохозяйка часто использует для наведения чистоты следующие средства:
- Отбеливатели.
- Препараты, предназначенные для борьбы с плесенью.
- Таблетки, моющие жидкости, в составе которых есть данный элемент.
- Порошки, растворы для общей дезинфекции помещения.
Последствия воздействия хлора на организм

Постоянное воздействие даже малых доз хлора (агрегатное состояние может быть любым) на человеческий организм грозит для людей следующим:
- Фарингит.
- Ларингит.
- Бронхит (в острой либо хронической форме).
- Различные заболевания кожных покровов.
- Гайморит.
- Пневмосклероз.
- Трахеит.
- Ухудшение зрения.
Если вы заметили у себя один из недугов, перечисленных выше, при условии, что постоянно или однократно (случаи посещения бассейна сюда тоже относится) подвергались влиянию паров хлора, то это повод для скорейшего обращения к специалисту! Доктор назначит комплексную диагностику для изучения природы заболевания. Изучив ее результаты, затем он назначит лечение.
Первая помощь при отравлении

Хлор - газ, вдыхать который очень опасно, особенно в больших объемах! При средней, тяжелой форме отравления пострадавшему нужно немедленно оказать первую помощь:
- В каком бы ни был состоянии человек, не паникуйте. Вам следует первым делом взять себя в руки, а затем успокоить и его.
- Выведите пострадавшего на свежий воздух или же в проветриваемое помещение, где нет хлорных паров.
- Как можно быстрее вызовите скорую помощь.
- Позаботьтесь, чтобы человек был в тепле и комфорте - накройте его пледом, одеялом или простыней.
- Проследите, чтобы он легко и свободно дышал - снимите тесную одежду, украшения с шеи.
Медикаментозная помощь при отравлении
До приезда бригады скорой медпомощи можно самостоятельно помочь потерпевшему, используя ряд бытовых и медикаментозных препаратов:
- Приготовьте 2% раствор пищевой соды. Этой жидкостью промойте пострадавшему глаза, нос, ротовую полость.
- Закапайте ему в глаза вазелиновое или оливковое масло.
- Если человек жалуется на боль, рези в глазах, то в данном случае лучше всего будет 0,5% раствор дикаина. На каждый глаз по 2-3 капельки.
- Для профилактики также накладывают глазную мазь - синтомициноваую (0,5%), сульфаниловую (10%).
- В качестве замены глазной мази можно использовать альбуцид (30%), раствор сульфата цинка (0,1%). Данные препараты закапывают пострадавшему дважды в день.
- Внутримышечное, внутривенное введение инъекций. «Преднизолон» - 60 мг (внутривенно или внутримышечно), «Гидрокортизон» - 125 мг (внутримышечно).
Профилактика

Зная, насколько опасен хлор, какое вещество оказывает действие на организм человека, лучше всего заранее позаботиться о снижении или исключении его негативного влияния на свой организм. Добиться этого можно следующими способами:
- Соблюдение санитарных норм на рабочем месте.
- Регулярное прохождение медицинских осмотров.
- Использование средств защиты при работе с хлорсодержащими препаратами дома или на работе - тот же респиратор, плотные защитные резиновые перчатки.
- Соблюдение предписаний техники безопасности при работе с веществом в промышленной среде.
Работа с хлором всегда требует осторожности как в промышленных масштабах, так и в бытовых. Вы знаете, как диагностировать у себя признаки отравления веществом. Помощь же пострадавшему нужно оказывать незамедлительно!
Хлор — элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [ 10 Ne ]3s 2 Зр 5 , характерные степени окисления 0, -1, + 1, +5 и +7. Наиболее устойчиво состояние Cl -1 . Шкала степеней окисления хлора:
7 – Cl 2 O 7 , ClO 4 — ,HClO 4 , KClO 4
5 — ClO 3 — , HClO 3 ,KClO 3
1 – Cl 2 O , ClO — , HClO , NaClO , Ca(ClO) 2
— 1 – Cl — , HCl, KCl , PCl 5
Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ — оксидов, кислот, солей, бинарных соединений.
В природе — двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хлор С1 2 . Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Сl 2 неполярна, содержит σ-связь С1-С1. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре):
Cl 2 +H 2 ⇌HCl
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью — в щелочном растворе:
Cl 2 0 +H 2 O ⇌HCl I O+HCl -I
Cl 2 +2NaOH (хол) = NaClO+NaCl+H 2 O
3Cl 2 +6NaOH (гор) =NaClO 3 +5NaCl+H 2 O
Раствор хлора в воде называют хлорной водой , на свету кислота НСlO разлагается на НСl и атомарный кислород О 0 , поэтому «хлорную воду» надо хранить в темной склянке. Наличием в «хлорной воде» кислоты НСlO и образованием атомарного кислорода объясняются ее сильные окислительные свойства: например, во влажном хлоре обесцвечиваются многие красители.
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Сl 2 + 2Nа = 2NаСl 2
ЗСl 2 + 2Fе→2FеСl 3 (200 °С)
Сl 2 +Se=SeCl 4
Сl 2 + РЬ→PbCl 2 (300 ° С )
5Cl 2 +2P→2PCl 5 (90 °С)
2Cl 2 +Si→SiCl 4 (340 °С)
Реакции с соединениями других галогенов:
а) Сl 2 + 2КВг (Р) = 2КСl + Вr 2 (кипячение)
б) Сl 2 (нед.) + 2КI (р) = 2КСl + I 2 ↓
ЗСl (изб.) + 3Н 2 O+ КI = 6НСl + КIO 3 (80 °С)
Качественная реакция — взаимодействие недостатка СL 2 с КI (см. выше) и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности :
2NаСl (расплав) → 2Nа + Сl 2 (электролиз)
2NaCl+ 2Н 2 O→Н 2 + Сl 2 + 2NаОН (электролиз)
и в лаборатории :
4НСl (конц.) + МnO 2 = Сl 2 + МnСl 2 + 2Н 2 O
(аналогично с участием других окислителей; подробнее см. реакции для НСl и NaСl).
Хлор относится к продуктам основного химического производства, используется для получения брома и йода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Хлороводород НС l . Бескислородная кислота. Бесцветный газ с резким запахом, тяжелее воздуха. Молекула содержит ковалентную σ -связь Н — Сl. Термически устойчив. Очень хорошо растворим в воде; разбавленные растворы называются хлороводородной кислотой , а дымящий концентрированный раствор (35-38 %)- соляной кислотой (название дано еще алхимиками). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Сильный восстановитель в концентрированном растворе (за счет Сl — I), слабый окислитель в разбавленном растворе (за счет Н I). Составная часть «царской водки».
Качественная реакция на ион Сl — — образование белых осадков АgСl и Нg 2 Сl 2 , которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций:
НСl (разб.) + NаОН (разб.) = NaСl + Н 2 O
НСl (разб.) + NН 3 Н 2 O = NH 4 Сl + Н 2 O
4НСl (конц., гор.) + МO 2 = МСl 2 + Сl 2 + 2Н 2 O (М = Мп, РЬ)
16НСl (конц., гор.) + 2КМnO 4(т) = 2МnСl 2 + 5Сl 2 + 8Н 2 O + 2КСl
14НСl (конц.) + К 2 Сr 2 O 7(т) = 2СrСl 3 + ЗСl 2 + 7Н 2 O + 2КСl
6НСl (конц.) + КСlO 3(Т) = КСl + ЗСl 2 + 3Н 2 O (50-80 °С)
4НСl (конц.) + Са(СlO) 2(т) = СаСl 2 + 2Сl 2 + 2Н 2 O
2НСl (разб.) + М = МСl 2 + H 2 (М = Ре, 2п)
2НСl (разб.) + МСO 3 = МСl 2 + СO 2 + Н 2 O (М = Са, Ва)
НСl (разб.) + АgNO 3 = НNO 3 + АgСl↓
Получение НСl в промышленности — сжигание Н 2 в Сl 2 (см.), в лаборатории — вытеснение из хлоридов серной кислотой:
NаСl (т) + Н 2 SO4 (конц.) = NаНSO 4 + НС l (50 °С)
2NaСl (т) + Н 2 SO 4 (конц.) = Nа 2 SO 4 + 2НСl (120 °С)
Хлориды
Хлорид натрия Na Сl . Бескислородная соль. Бытовое название поваренная соль . Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе — основная часть залежей каменной соли, или галита , и сильвинита (вместе с КСl),рапы соляных озер, минеральных примесей морской воды (содержание NaСl=2,7%). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
2NаСl (т) + 2Н 2 SO 4 (конц.) + МnO 2(т) = Сl 2 + МnSO 4 + 2Н 2 O + Na 2 SO 4 (100 °С)
10NаСl (т) + 8Н 2 SO 4 (конц.) + 2КМnO 4(т) = 5Сl 2 + 2МnSO 4 + 8Н 2 О + 5Nа 2 SO 4 + К 2 SO 4 (100°С)
6NaСl (Т) + 7Н 2 SO 4 (конц.) + К 2 Сr 2 O 7(т) = 3Сl 2 + Сr 2 (SO 4) 3 + 7Н 2 O+ ЗNа 2 SO 4 + К 2 SO 4 (100 °С)
2NаСl (т) + 4Н 2 SO 4 (конц.) + РЬO 2(т) = Сl 2 + Рb(НSO 4) 2 + 2Н 2 O + 2NaНSO 4 (50 °С)
NaСl (разб.) + АgNO 3 = NaNО 3 + АgСl↓
NaCl (ж) →2Na+Cl 2 (850°С, электролиз)
2NаСl + 2Н 2 O→Н 2 + Сl 2 + 2NаОН (электролиз)
2NаСl (р,20%) → Сl 2 + 2 N а(Н g ) “амальгама” (электролиз,на Hg -катоде)
Хлорид калия КСl . Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Сl 2 . В природе основная составная часть (наравне с NаСl) залежей сильвинита .
Уравнения важнейших реакций одинаковы с таковыми для NаСl.
Хлорид кальция СаСl 2 . Бескислородная соль. Белый, плавится без разложения. Расплывается на воздухе за счет энергичного поглощения влаги. Образует кристаллогидрат СаСl 2 6Н 2 О с температурой обезвоживания 260 °С. Хорошо растворим в воде, гидролиза нет. Вступает в реакции ионного обмена. Применяется для осушения газов и жидкостей, приготовления охлаждающих смесей. Компонент природных вод, составная часть их «постоянной» жесткости.
Уравнения важнейших реакций:
СаСl 2(Т) + 2Н 2 SO 4 (конц.) = Са(НSO 4) 2 + 2НСl (50 °С)
СаСl 2(Т) + Н 2 SO 4 (конц.) = СаSO 4 ↓+ 2НСl (100 °С)
СаСl 2 + 2NaОН (конц.) = Са(ОН) 2 ↓+ 2NaCl
ЗСаСl 2 + 2Nа 3 РO 4 = Са 3 (РO 4) 2 ↓ + 6NaCl
СаСl 2 + К 2 СO 3 = СаСО 3 ↓ + 2КСl
СаСl 2 + 2NaF = СаF 2 ↓+ 2NаСl
СаСl 2(ж) → Са + Сl 2 (электролиз,800°С)
Получение:
СаСО 3 + 2НСl = СаСl 2 + СO 3 + Н 2 O
Хлорид алюминия АlСl 3 . Бескислородная соль. Белый, легкоплавкий,сильнолетучий. В паре состоит из ковалентных мономеров АlСl 3 (треугольное строение,sр 2 гибридизация, преобладают при 440-800 °С) и димеров Аl 2 Сl 6 (точнее, Сl 2 АlСl 2 АlСl 2 , строение — два тетраэдра с общим ребром, sр 3 -гибридизация, преобладают при 183-440 °С). Гигроскопичен, па воздухе «дымит». Образует кристаллогидрат, разлагающийся при нагревании. Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, создает в растворе сильнокислотную среду вследствие гидролиза. Реагирует со щелочами, гидратом аммиака. Восстанавливается при электролизе расплава. Вступает в реакции ионного обмена.
Качественная реакция на ион Аl 3+ — образование осадка АlРO 4 , который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
АlСl 3 . 6Н 2 O →АlСl(ОН) 2 (100-200°С, — HCl , H 2 O ) →Аl 2 O 3 (250-450°С, -HCl,H2O)
АlСl 3(т) + 2Н 2 O (влага) = АlСl(ОН) 2(т) + 2НСl (белый «дым»)
АlCl 3 + ЗNаОН (разб.) = Аl(OН) 3 (аморф.) ↓ + ЗNаСl
АlСl 3 + 4NаОН (конц.) = Nа[Аl(ОН) 4 ] + ЗNаСl
АlСl 3 + 3(NН 3 . Н 2 O) (конц.) = Аl(ОН) 3(аморф.) + ЗNН 4 Сl
АlCl 3 + 3(NН 3 Н 2 O) (конц.) =Аl(ОН)↓ + ЗNН 4 Сl + Н 2 O (100°С)
2Аl 3+ + 3Н 2 O + ЗСО 2- 3 = 2Аl(ОН) 3 ↓ + ЗСO 2 (80°С)
2Аl 3+ =6Н 2 O+ 3S 2- = 2Аl(ОН) 3 ↓+ 3Н 2 S
Аl 3+ + 2НРО 4 2- — АlРO 4 ↓ + Н 2 РO 4 —
2АlСl 3 →2Аl + 3Сl 2 (электролиз,800 °С ,в расплаве N аС l )
Получение АlСl в промышленност и — хлорирование каолина, глинозёма или боксита в присутствии кокса:
Аl 2 O 3 + 3С (кокс) + 3Сl 2 = 2АlСl 3 + 3СО (900 °С)
Хлорид железа( II ) F еС l 2 . Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке НСl. Связи Fе — Сl преимущественно ковалентные, пар состоит из мономеров FеСl 2 (линейное строение, sр-гибридизация) и димеров Fе 2 Сl 4 . Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FеСl и Fе 2 О 3 , как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
FеСl 2 4Н 2 O = FеСl 2 + 4Н 2 O (220 °С, в атм. N 2 )
FеСl 2 (конц.) + Н 2 O=FеСl(ОН)↓ + НСl (кипячение)
FеСl 2(т) + Н 2 SO 4 (конц.) = FеSO 4 + 2НСl (кипячение)
FеСl 2(т) + 4HNO 3 (конц.) = Fе(NO 3) 3 + NO 2 + 2НСl + Н 2 O
FеСl 2 + 2NаОН (разб.) = Fе(ОН) 2 ↓+ 2NaСl (в атм. N 2 )
FеСl 2 + 2(NН 3 . Н 2 O) (конц.) = Fе(ОН) 2 ↓ + 2NН 4 Cl (80 °С)
FеСl 2 + Н 2 = 2НСl + Fе (особо чистое,выше 500 °С)
4FеСl 2 + O 2 (воздух) → 2Fе(Сl)O + 2FеСl 3 (t )
2FеСl 2(р) + Сl 2 (изб.) = 2FеСl 3(р)
5Fе 2+ + 8Н + + МnО — 4 = 5Fе 3+ + Мn 2+ + 4Н 2 O
6Fе 2+ + 14Н + + Сr 2 O 7 2- = 6Fе 3+ + 2Сr 3+ +7Н 2 O
Fе 2+ + S 2- (разб.) = FеS↓
2Fе 2+ + Н 2 O + 2СО 3 2- (разб.) = Fе 2 СO 3 (OН) 2 ↓+ СO 2
FеСl 2 →Fе↓ + Сl 2 (90°С, в разб. НСl, электролиз)
Получени е: взаимодействие Fе с соляной кислотой:
Fе + 2НСl = FеСl 2 + Н 2
(в промышленности используют хлороводород и ведут процесс при 500 °С).
Хлорид железа( III ) F еС l 3 . Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fе — Сl преимущественно ковалентные. Пар состоит из мономеров FеСl 3 (треугольное строение, sр 2 -гибридизация, преобладают выше 750 °С) и димеров Fе 2 Сl 6 (точнее, Сl 2 FеСl 2 FеСl 2 , строение — два тетраэдра с общим ребром, sр 3 -гибридизация, преобладают при 316-750 °С). Кристаллогидрат FеСl . 6Н 2 O имеет строение Сl 2Н 2 O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
FеСl 3 6Н 2 O=Сl + 2Н 2 O (37 °С)
2(FеСl 8 6Н 2 O)=Fе 2 O 3 + 6НСl + 9Н 2 O (выше 250 °С)
FеСl 3 (10%) + 4Н 2 O = Сl — + + (желт.)
2FеСl3 (конц.) + 4Н 2 O = + (желт.) + — (бц.)
FеСl 3 (разб., конц.) + 2Н 2 O →FеСl(ОН) 2 ↓ + 2НСl (100 °С)
FеСl 3 + 3NaОН (разб.) = FеО(ОН)↓ + Н 2 O + 3NаСl (50 °С)
FеСl 3 + 3(NН 3 Н 2 O) (конц, гор.) =FeO(OH)↓+H 2 O+3NH 4 Cl
4FеСl 3 + 3O 2 (воздух) =2Fе 2 O 3 + 3Сl 2 (350-500 °С)
2FеСl 3(р) + Сu→ 2FеСl 2 + СuСl 2
Хлорид аммония N Н 4 Сl . Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо-эффектом, Q = -16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию кон мутации с нитратами.
Качественная реакция на ион NН 4 + — выделение NН 3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
NH 4 Cl (т) ⇌ NH 3(г) + HCl (г) (выше337,8 °С)
NН 4 Сl + NаОН (насыщ.) = NаСl + NН 3 + Н 2 O (100 °С)
2NН 4 Сl (Т) + Са(ОН) 2(т) = 2NН 3 + СаСl 2 + 2Н 2 O (200°С)
2NН 4 Сl (конц.) +Mg= Н 2 + МgСl 2 + 2NН 3 (80°С)
2NН 4 Сl (конц., гор.) + Мg(ОН) 2 = MgСl 2 + 2NН 3 + 2Н 2 O
NH + (насыщ.) + NO — 2 (насыщ.) =N 2 + 2Н 2 O (100°С)
NН 4 Сl + КNO 3 = N 2 O + 2Н 2 O + КСl (230-300 °С)
Получение : взаимодействие NH 3 с НСl в газовой фазе или NН 3 Н 2 О с НСl в растворе.
Гипохлорит кальция Са(С l О) 2 . Соль хлорноватистой кислоты НСlO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести — смеси неопределенного состава с СаСl 2 и Са(ОН) 2 . Уравнения важнейших реакций:
Са(СlO) 2 = СаСl 2 + O 2 (180 °С)
Са(СlO) 2(т) + 4НСl (конц.) = СаСl + 2Сl 2 + 2Н 2 O (80 °С)
Са(СlO) 2 + Н 2 O + СO 2 = СаСО 3 ↓ + 2НСlO (на холоду)
Са(СlO) 2 + 2Н 2 O 2 (разб.) = СаСl 2 + 2Н 2 O + 2O 2
Получение:
2Са(ОН) 2 (суспензия) + 2Сl 2(г) = Са(СlO) 2 + СаСl 2 + 2Н 2 O
Хлорат калия КС lO 3 . Соль хлорноватой кислоты НСlO 3 , наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории — твердый источник кислорода.
Уравнения важнейших реакций:
4КСlO 3 = ЗКСlO 4 + КСl (400 °С)
2КСlO 3 = 2КСl + 3O 2 (150-300 °С, кат. Мп O 2 )
КСlO 3(Т) + 6НСl (конц.) = КСl + 3Сl 2 + ЗН 2 O (50-80 °С)
3КСlO 3(Т) + 2Н 2 SO 4 (конц., гор.) = 2СlO 2 + КСlO 4 + Н 2 O + 2КНSO 4
(диоксид хлора на свету взрывается: 2С lO 2(Г) = Сl 2 + 2 O 2 )
2КСlO 3 + Е 2(изб.) = 2КЕO 3 + Сl 2 (в разб. Н NO 3 , Е = В r , I )
KClO 3 +H 2 O→H 2 +KClO 4 (Электролиз)
Получение КСlO 3 в промышленности — электролиз горячего раствора КСl (продукт КСlO 3 выделяется на аноде):
КСl + 3Н 2 O →Н 2 + КСlO 3 (40-60 °С,Электролиз)
Бромид калия КВ r . Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем
Качественная реакция на ион Вr — вытеснение брома из раствора КВr хлором и экстракция брома в органический растворитель, например ССl 4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
2КВr (т) + 2Н 2 SO 4 (КОНЦ., гор,) + МnO 2(т) =Вr 2 + МnSO 4 + 2Н 2 O + К 2 SO 4
5Вr — + 6Н + + ВrО 3 — = 3Вr 2 + 3Н 2 O
Вr — + Аg + =АgВr↓
2КВr (р) +Сl 2(Г) =2КСl + Вг 2(р)
КВr + 3Н 2 O→3Н 2 + КВrО 3 (60-80 °С, электролиз)
Получение:
К 2 СO 3 + 2НВr = 2КВ r + СO 2 + Н 2 O
Иодид калия К I . Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор КI хорошо растворяет I 2 за счет комплексообразования.
Качественная реакция на ион I — вытеснение иода из раствора КI недостатком хлора и экстракция иода в органический растворитель, например ССl 4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
10I — + 16Н + + 2МnO 4 — = 5I 2 ↓ + 2Мn 2+ + 8Н 2 O
6I — + 14Н + + Сr 2 O 7 2- =3I 2 ↓ + 2Сr 3+ + 7Н 2 O
2I — + 2Н + + Н 2 O 2 (3%) = I 2 ↓+ 2Н 2 O
2I — + 4Н + + 2NO 2 — = I 2 ↓ + 2NO + 2Н 2 O
5I — + 6Н + + IO 3 — = 3I 2 + 3Н 2 O
I — + Аg + = АgI (желт .) ↓
2КI (р) + Сl 2(р) (нед.) =2КСl + I 2 ↓
КI + 3Н 2 O + 3Сl 2(р) (изб.) = КIO 3 + 6НСl (80°С)
КI (Р) + I 2(т) =K) (Р) (кор.) («йодная вода»)
КI + 3Н 2 O→ 3Н 2 + КIO 3 (электролиз,50-60 °С)
Получение:
К 2 СO 3 + 2НI = 2 К I + СO 2 + Н 2 O